


й’ҲеүӮжҳҜж— иҸҢеҲ¶еүӮдёӯзҡ„йҮҚиҰҒеүӮеһӢгҖӮ
й’ҲеүӮеҲҶзІүй’Ҳе’Ңж°ҙй’ҲдёӨз§ҚпјҢеҸҜд»Ҙжңүе®үз“ҝгҖҒиҘҝжһ—瓶гҖҒйў„е…ҲзҒҢеҘҪзҡ„й’Ҳзӯ’зӯүж— иҸҢеҢ…иЈ…еҪўејҸгҖӮ
зІүй’Ҳз”ҹдә§зҡ„жҲҗе“ҒдёҚиғҪдҪңжңҖз»ҲзҒӯиҸҢеӨ„зҗҶ{ж°ҙй’Ҳз”ҹдә§зҡ„жҲҗе“ҒеҲҷжңүиғҪжңҖз»ҲзҒӯиҸҢе’ҢдёҚиғҪжңҖз»ҲзҒӯиҸҢд№ӢеҲҶпјҢиҝҳиҰҒиҖғиҷ‘еӨ§гҖҒе°Ҹе®№йҮҸпјҲд»Ҙ500 mlдёәз•Ңпјүзҡ„еҢәеҲ«гҖӮ
зІүй’ҲеүӮзҡ„з”ҹдә§е·ҘеәҸеҢ…жӢ¬пјҡ
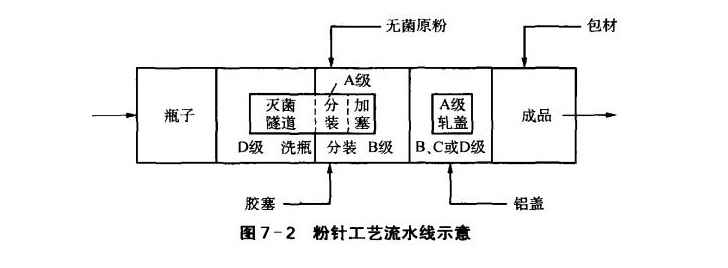
(1)жҙ—瓶з”ұдәҺзІүй’ҲжҳҜйқһжңҖз»ҲзҒӯиҸҢиҚҜе“ҒВ·жүҖд»Ҙжҙ—瓶дёӯзҡ„жңҖз»Ҳжё…жҙ—жңҖдҪҺеҝ…йЎ»дҝқжҢҒDзә§пјҢз”Ёж°ҙдёәжіЁе°„з”Ёж°ҙгҖӮиҰҒжіЁж„Ҹжҙ—еҮҖзҡ„瓶еӯҗзҡ„еӯҳж”ҫе’Ңдј йҖҒпјҢе…¶зҺҜеўғеә”дёҺз”ҹдә§иҪҰй—ҙзҡ„жҙҒеҮҖеәҰзӣёеҗҢпјҢеҚіеӯҳж”ҫе’Ңдј йҖҒзҡ„жҡҙйңІзҺҜеўғпјҢиҰҒжұӮBзә§иғҢжҷҜдёӢзҡ„Aзә§гҖӮ
(2)иғ¶еЎһеӨ„зҗҶе’Ңжҙ—瓶жңүеҗҢж ·зҡ„иҰҒжұӮпјҢйҷӨдёҒеҹәиғ¶еЎһеӨ–пјҢе…¶д»–иғ¶еЎһиҝҳеҸҜе…Ҳз”ЁзЁҖзӣҗй…ёз…®жҙ—гҖӮ
(3)зҺ»з“¶е’ҢеЎһеӯҗзҒӯиҸҢиҰҒжіЁж„ҸеҪ“з”ЁеҸҢжүүејҸз”өзғҳз®ұзҒӯиҸҢж—¶пјҢз”өзғҳз®ұзҡ„иҝӣж°”еә”жңүдәҡй«ҳж•Ҳд»ҘдёҠж•ҲзҺҮзҡ„иҝҮж»ӨеҷЁпјҢзҒӯиҸҢеҗҺзҡ„еҶ·еҚҙеҝ…йЎ»жңүBзә§дёӢAзә§зҡ„зҺҜеўғпјҢзҒӯиҸҢиҝҮзЁӢд№ҹеҸҜд»ҘеҒҡжҲҗзҒӯиҸҢйҡ§йҒ“гҖӮ
(4)еҲҶиЈ…гҖҒеҠ еЎһиҰҒжіЁж„ҸеҲҶиЈ…еҸЈжҳҜжңҖе…ій”®зҡ„йғЁдҪҚпјҢеҲҶиЈ…е·ҘеәҸе°Өе…¶жҳҜеҲҶиЈ…еҸЈпјҢеҝ…йЎ»еңЁAзә§еҢәзҺҜеўғдёӯпјӣеҲҶиЈ…е®ӨеҶ…дёәдҝқиҜҒжңүи¶іеӨҹзҡ„ж—¶й—ҙж¶ҲжҜ’пјҢдёҚеә”е®үжҺ’дёүзҸӯз”ҹдә§пјӣжҺҘи§ҰиҚҜзІүзҡ„йғЁд»¶жҜҸеӨ©еә”жӢҶжҙ—зҒӯиҸҢпјӣж°”жөҒеҲҶиЈ…жңәз”Ёзҡ„еҺӢзј©з©әж°”еҝ…йЎ»з»ҸйҷӨжІ№е’Ңй«ҳж•ҲиҝҮж»ӨеҷЁеӨ„зҗҶпјҢиҰҒиҫҫеҲ°иҪҰй—ҙжҙҒеҮҖеәҰжҲ–й«ҳдәҺиҪҰй—ҙжҙҒеҮҖеәҰпјҢ并且зӣёеҜ№ж№ҝеәҰиҰҒдҪҺдәҺ20%;з”ұдәҺеҺӢеЎһж—¶еЎһеӯҗжңүеј№иө·зҡ„еҸҜиғҪпјҢжүҖд»Ҙж— иҸҢеҲ¶е“ҒгҖҒиҸҢиӢ—з–«иӢ—еҲ¶е“Ғзҡ„еҺӢеЎһеә”еңЁBзә§дёӢзҡ„Aзә§дёӯиҝӣиЎҢпјҢз”ұдәҺзІүеүӮеҗёж№ҝжҖ§ејәпјҢеҲҶиЈ…е®Өзҡ„зӣёеҜ№ж№ҝеәҰиҰҒдҪҺгҖӮ
(5)еҶ»е№ІеҰӮжһңжҳҜеҶ»е№ІзІүпјҢиҝҳеә”еңЁеҲҶиЈ…еҗҺйҖҒдәәеҶ»е№ІжңәеҶ»е№ІгҖӮ
(6)иҪ§еҺӢзӣ–з”ұдәҺиҚҜ瓶еңЁе®ҢжҲҗиҪ§зӣ–еүҚиҝҳжңӘеҪўжҲҗе®Ңж•ҙеҜҶе°Ғзі»з»ҹпјҢеңЁе°ҒгҖҒиҪ§зӣ–иҝҮзЁӢдёӯдјҡдә§з”ҹйҮ‘еұһеҫ®зІ’жұЎжҹ“дә§е“ҒпјҢжүҖд»ҘGMP(2010)еҜ№иҪ§зӣ–еҢәжңҖй«ҳиҰҒжұӮд№ҹжҳҜBзә§иғҢжҷҜдёӢзҡ„Aзә§зҡ„еҚ•еҗ‘жөҒеҢәпјҲд№ҹеҸҜд»ҘжҳҜCпјҢDзә§иғҢжҷҜпјүгҖӮиҝҷд№ҹжҳҜ欧зӣҹGMPжҸҗеҮәзҡ„иҰҒжұӮпјҢиҖҢиҝҮеҺ»GMP(1998)еҸӘиҰҒжұӮ8зә§жҙҒеҮҖеәҰгҖӮ
зҺ°иЎҢGMPиҝҳиҰҒжұӮиҪ§зӣ–жңүеҚ•зӢ¬зҡ„еҢәеҹҹпјҢеҗҰеҲҷиҰҒиҜҒжҳҺжІЎжңүеҚ•зӢ¬еҢәеҹҹдёҚдјҡжңүдёҚеҲ©еҪұе“ҚпјҢ
(7)еҢ…иЈ…еӣҫ7-1жҳҜиҝҷдёҖе·Ҙиүәзҡ„е…ёеһӢжөҒзЁӢпјҢеёёи§ҒиҜёеӣҪеӨ–жңүе…іж— иҸҢеҲ¶еүӮзҡ„ж–ҮзҢ®гҖӮеӣҫ7-2дёәиҝҷдёҖе·ҘиүәжөҒж°ҙзәҝзҡ„зӨәж„ҸеӣҫгҖӮ

дҪңдёәзІүй’Ҳз”ҹдә§зҡ„зү№зӮ№пјҢдёҖжҳҜжңүиҚҜе°ҳйЈһжү¬й—®йўҳпјҢдәҢжҳҜеҲҶиЈ…еҜ№еҗёж№ҝжҖ§еҫҲејәпјҢзү№еҲ«жҳҜеҶ»е№Ідә§е“ҒпјҢжүҖ
д»Ҙзү№еҲ«иҰҒжіЁж„ҸзӣёеҜ№ж№ҝеәҰе’Ңе·Ҙе…·гҖҒе®№еҷЁзҡ„е№ІзҮҘгҖӮе…ідәҺиҚҜе°ҳй—®йўҳе°ҶеңЁзүҮеүӮдёҖиҠӮдәҲд»ҘиҜҙжҳҺгҖӮ
жң¬ж–Үж ҮзӯҫпјҡжҙҒеҮҖзҺҜеўғ
ең°еқҖпјҡеұұдёңзңҒжөҺеҚ—еёӮеӨ©жЎҘеҢәж–°еҫҗеұ…委дјҡй»„жІіе»әйӮҰеӨ§жЎҘиҘҝдҫ§1-6еҸ· з”өиҜқпјҡ0531-68824415 дј зңҹпјҡ0531-68824415
зүҲжқғжүҖжңү:жөҺеҚ—йЎәеҘҮеҮҖеҢ–е·ҘзЁӢжңүйҷҗе…¬еҸё жҠҖжңҜж”ҜжҢҒпјҡеә·зҫҺ科жҠҖ еӨҮжЎҲеҸ·:йІҒICPеӨҮ19040779еҸ· xmlең°еӣҫ htmlең°еӣҫ txtең°еӣҫ зҷ»еҪ•